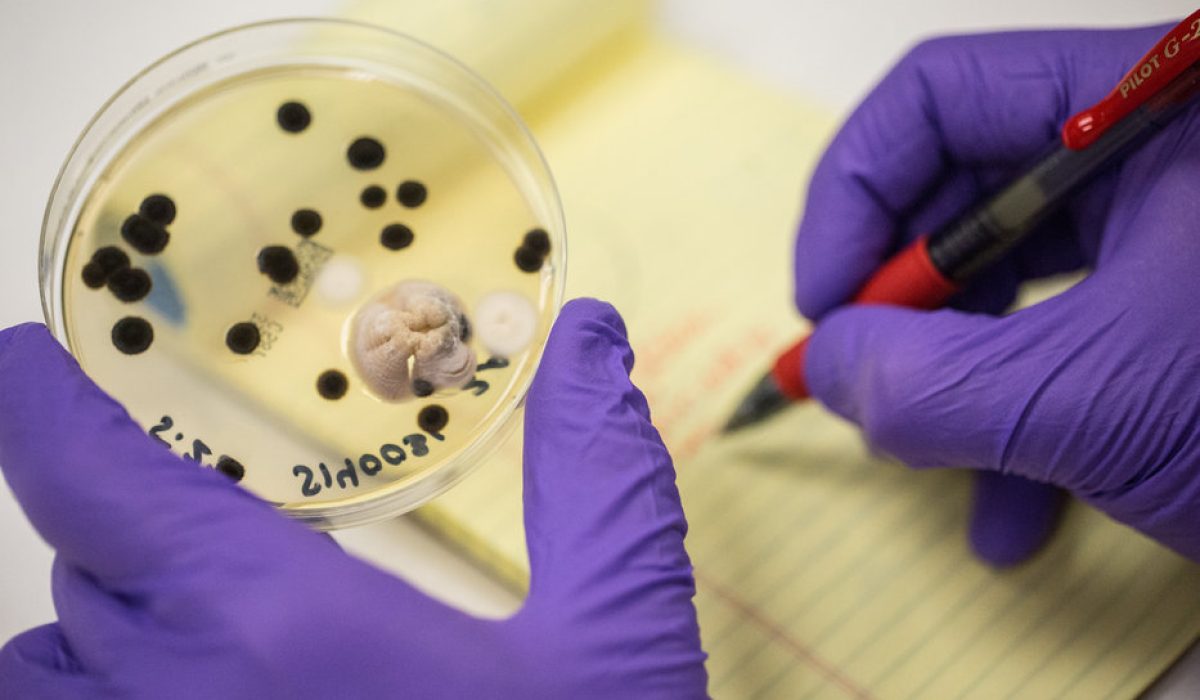
در فرآیند تولید محصولات دارویی، آرایشی و بهداشتی، کیفیت مواد اولیه نقش بنیادین و تعیینکنندهای در تضمین ایمنی، پایداری و اثربخشی محصول نهایی دارد. مواد اولیه میتوانند منشأهای گوناگونی داشته باشند — از ترکیبات سنتزی و شیمیایی گرفته تا مواد زیستی و استخراجشده از منابع گیاهی یا حیوانی — و همین تنوع منبع، احتمال بروز آلودگیهای میکروبی را بهویژه در مواد طبیعی افزایش میدهد.
حضور میکروارگانیسمها در مواد اولیه نهتنها میتواند باعث فساد فیزیکی و شیمیایی ترکیبات شود، بلکه از منظر ایمنی نیز تهدیدی جدی برای سلامت مصرفکننده محسوب میگردد. برخی از این میکروارگانیسمها قادرند سموم یا متابولیتهای سمی تولید کنند (نظیر مایکوتوکسینها)، برخی دیگر در شرایط مناسب رشد کرده و منجر به تغییر در ویژگیهای دارویی ماده یا غیرفعال شدن مواد مؤثره شوند. حتی مقادیر اندک آلودگی میکروبی میتواند به تغییر در pH، رنگ، بوی محصول یا در بدترین حالت، ایجاد خطر عفونت در بیمار منجر گردد.
از دیدگاه اصول Good Manufacturing Practice (GMP)، یکی از پایهایترین الزامات کنترل کیفی، اطمینان از این است که هیچ ماده اولیهای پیش از انجام و تأیید آزمونهای میکروبیولوژیک، اجازه ورود به خط تولید را ندارد. کنترل میکروبی در این مرحله تضمین میکند که بار میکروبی مواد اولیه در محدوده مجاز قرار دارد و هیچگونه میکروارگانیسم بالقوه خطرناک یا عامل فساد در مسیر تولید وارد نمیشود. زیرا افزایش بار میکروبی در خطوط فرآیند نهتنها میتواند منجر به آلودگی متقاطع محصولات شود، بلکه کنترلهای بعدی را نیز پیچیدهتر کرده و احتمال رد دستههای تولیدی (Batch Rejection) را بهشدت افزایش میدهد.
به همین دلیل، کنترل میکروبی مواد اولیه شرط ورود ایمن آنها به سیستم تولید است. این کنترل بهمنزلهی اولین سد دفاعی در برابر آلودگیهای میکروبی به شمار میرود و اجرای دقیق آن، پایهی استقرار نظام کیفیت پایدار در واحدهای تولیدی دارویی و آرایشی است. مستندسازی نتایج این آزمونها، نگهداری سوابق، و پایش دورهای روند نتایج میتواند شاخصی مهم از سلامت میکروبی کل زنجیره تأمین و تولید باشد.
اهمیت کنترل میکروبی مواد اولیه
مواد اولیه، بهویژه آنهایی که منشأ طبیعی دارند — مانند عصارههای گیاهی، پروتئینهای نوترکیب، فرآوردههای آلی یا سایر مواد زیستی — بهطور ذاتی مستعد آلودگی میکروبی هستند. رطوبت بالا، ترکیبات آلی مغذی و شرایط نگهداری نامناسب، محیطی ایدهآل برای رشد میکروارگانیسمها فراهم میکنند. در صورت عدم انجام کنترلهای میکروبی دقیق در مرحله ورود مواد اولیه، این آلودگیها میتوانند پیامدهای گسترده و گاه غیرقابل جبرانی برای فرآیند تولید و کیفیت محصول نهایی بههمراه داشته باشند.
نخست، انتقال آلودگی به خطوط تولید میتواند منجر به آلودگی متقاطع در دستههای مختلف محصول شود. حضور میکروارگانیسمها در سیستمهای فرآیندی یا ظروف نگهداری ممکن است موجب تشکیل بیوفیلم، افزایش بار میکروبی محیطی و در نهایت ایجاد نقاط بحرانی در کنترل فرآیند گردد.
دوم، تغییر در خواص فیزیکی و شیمیایی مواد اولیه از دیگر تبعات آلودگی است. فعالیتهای متابولیکی میکروارگانیسمها میتواند باعث تخریب ترکیبات مؤثره، اکسیداسیون یا هیدرولیز اجزای حساس، و در نتیجه کاهش پایداری یا اثربخشی ماده گردد.
سوم، وجود میکروارگانیسمها میتواند بر نتایج آزمونهای پایداری و ایمنی تأثیرگذار باشد. افزایش بار میکروبی در نمونههای در حال مطالعه، ممکن است بهاشتباه بهعنوان ناپایداری ذاتی ماده تفسیر شود یا در آزمونهای سمیت و ایمنی منجر به بروز پاسخهای غیرمنتظره گردد.
در نهایت، رشد برخی باکتریهای گرم منفی در مواد اولیه میتواند منجر به تولید اندوتوکسینها (Endotoxins) شود. این ترکیبات، که جزء لیپوپلیساکاریدهای غشای خارجی باکتریهای گرم منفی هستند، حتی در غیاب سلول زنده نیز قادرند واکنشهای شدید التهابی و تبزا در بدن ایجاد کنند. وجود اندوتوکسین در مواد اولیه، بهویژه در فرآوردههای تزریقی یا بیولوژیک، از دلایل اصلی Batch Rejection و بازگشت محصول از بازار (Recall) بهشمار میرود.
بنابراین، کنترل میکروبی دقیق و نظاممند مواد اولیه نهتنها پیششرط اطمینان از ایمنی و کیفیت محصول نهایی است، بلکه بهعنوان ابزاری پیشگیرانه از بروز مشکلات فرآیندی، آلودگیهای ثانویه، و خسارات اقتصادی ناشی از ریجکت یا ریکال محصولات جلوگیری میکند. اجرای این کنترلها مطابق با الزامات فارماکوپههای معتبر (USP <61>, <62>، Ph. Eur. 2.6.12 و 2.6.13) و دستورالعملهای GMP، بخش جداییناپذیر از چرخه مدیریت کیفیت در صنایع دارویی بهشمار میرود.
انواع آلودگیهای میکروبی در مواد اولیه
آلودگی میکروبی مواد اولیه میتواند از منابع مختلفی مانند محیط تولید، تجهیزات فرآیندی، بستهبندی، یا حتی زنجیره تأمین مواد خام ناشی شود. شناسایی نوع میکروارگانیسمهای محتمل در هر ماده اولیه، پایهگذار طراحی برنامه کنترل و انتخاب روش آزمون مناسب است. مهمترین گروههای آلودگی میکروبی در مواد اولیه شامل موارد زیر هستند:
۱. باکتریهای هوازی و بیهوازی
گونههایی مانند Bacillus, Pseudomonas و Clostridium از جمله باکتریهای رایج در مواد اولیه دارویی و آرایشی هستند. Bacillusها بهدلیل توانایی تشکیل اسپور، در برابر شرایط گرما و خشکی مقاوماند و میتوانند در مواد پودری یا خشک زنده بمانند. Pseudomonas aeruginosa بهویژه در مواد پایه آبی یا محصولات حاوی سورفکتانت رشد میکند و از مهمترین آلایندههای خطوط تولید است. Clostridiumها نیز بهصورت بیهوازی در محیطهای کماکسیژن رشد کرده و میتوانند سموم خطرناک تولید کنند.
۲. قارچها و کپکها
قارچها و مخمرهایی نظیر Aspergillus, Penicillium و Candida در مواد طبیعی، عصارههای گیاهی و پودرهای آلی بهوفور یافت میشوند. رشد این میکروارگانیسمها علاوه بر تغییر رنگ، بو و ظاهر مواد، میتواند منجر به تولید مایکوتوکسینها (مانند آفلاتوکسینها) شود که از نظر سمّیت، تهدید جدی برای ایمنی دارو و مصرفکننده محسوب میشوند.
۳. باکتریهای شاخص آلودگی مدفوعی (Fecal Indicators)
وجود باکتریهایی مانند Escherichia coli, اعضای خانواده Enterobacteriaceae و Salmonella spp. شاخص آلودگی با منشأ انسانی یا حیوانی است و نشاندهنده آلودگی در مراحل برداشت، حملونقل یا نگهداری ماده اولیه میباشد. این باکتریها از نظر فارماکوپهای در مواد اولیه دارویی و محصولات غیرخوراکی نیز غیرقابل قبول هستند و وجود آنها معمولاً منجر به رد (Rejection) دسته مواد اولیه میشود.
۴. میکروارگانیسمهای بیماریزا اختصاصی هر ماده اولیه
برخی مواد اولیه مستعد آلودگی با گونههای خاصی از میکروارگانیسمها هستند که به ترکیب یا منشأ آنها وابسته است. بهعنوان مثال، در مواد پروتئینی یا آنزیمی احتمال حضور Staphylococcus aureus وجود دارد، در حالی که در مواد استخراجشده از منابع آبی یا دریایی ممکن است Vibrio یا Aeromonas مشاهده شوند. شناسایی این آلودگیهای اختصاصی نیازمند طراحی روشهای آزمون هدفمند و معتبرسازیشده (Validated Methods) است.
روشهای انجام آزمون کنترل میکروبی
مطابق با فارماکوپههای معتبر (USP <61>, <62>، Ph. Eur. 2.6.12 و 2.6.13):
- شمارش میکروبی کلی (TAMC/TYMC)
- شمارش کل باکتریهای هوازی مزوفیل (TAMC) و قارچها و کپکها (TYMC) به روش کشت در پلیت آگار.
- نتایج معمولاً برحسب CFU/g گزارش میشوند.
- جستجوی میکروارگانیسمهای خاص
- بررسی عدم وجود E. coli, Salmonella spp., Pseudomonas aeruginosa, و Staphylococcus aureus.
- برای مواد اولیه گیاهی یا بیولوژیکی ممکن است آزمونهای اختصاصی دیگری نیز مورد نیاز باشد.
- آزمونهای سریع میکروبی (Rapid Microbial Methods)
- استفاده از روشهای ATP-bioluminescence، PCR یا qPCR برای شناسایی سریعتر و دقیقتر.
معیارهای پذیرش (Acceptance Criteria) در کنترل میکروبی مواد اولیه
محدودههای مجاز برای بار میکروبی و وجود یا عدم وجود میکروارگانیسمهای خاص، بسته به ماهیت ماده اولیه، روش مصرف محصول نهایی (خوراکی، تزریقی، موضعی) و شرایط فرآیند تولید میتواند متفاوت باشد.
در فارماکوپههای معتبر (نظیر USP <61>, <62> و Ph. Eur. 2.6.12–2.6.13) تصریح شده است که این مقادیر صرفاً راهنما (Guideline Values) هستند و در صورت نیاز، باید بر اساس ریسک میکروبی و نوع فرآورده، مقادیر سختگیرانهتر یا اختصاصیتری تعیین شود.
بهصورت کلی، حدود زیر بهعنوان مقادیر مرجع عمومی برای ارزیابی آلودگی میکروبی مواد اولیه مورد استفاده در صنایع دارویی، آرایشی و غذایی پیشنهاد میشوند:
| نوع ماده اولیه | TAMC (Total Aerobic Microbial Count) | TYMC (Total Yeast & Mold Count) | عدم وجود میکروارگانیسمهای خاص |
|---|---|---|---|
| مواد اولیه خوراکی (Oral Use) | ≤ 10⁴ CFU/g یا CFU/mL | ≤ 10² CFU/g یا CFU/mL | Escherichia coli و Salmonella spp. نباید وجود داشته باشند |
| مواد اولیه موضعی (Topical Use) | ≤ 10³ CFU/g یا CFU/mL | ≤ 10² CFU/g یا CFU/mL | Pseudomonas aeruginosa و Staphylococcus aureus نباید وجود داشته باشند |
| مواد اولیه تزریقی و استریل (Parenteral Use) | استریل باید باشند (Sterile) | استریل باید باشند | هیچ میکروارگانیسمی نباید وجود داشته باشد (Sterility must be demonstrated) |
نکات تکمیلی
- در مواد اولیه با منشأ طبیعی (مانند عصارههای گیاهی یا فرآوردههای بیولوژیک)، علاوه بر کنترل بار میکروبی، بررسی وجود اندوتوکسینها (Endotoxin) و سموم میکروبی احتمالی نیز الزامی است.
- در مواد اولیهای که برای فرآوردههای تزریقی یا چشمی استفاده میشوند، انجام آزمون استریلیتی (Sterility Test، USP <71>) اجباری است.
- اگر ماده اولیه حاوی مواد نگهدارنده آنتیمیکروبیال باشد، کارایی آنها باید در آزمون Antimicrobial Effectiveness Test (USP <51>) تأیید شود.
- هر شرکت تولیدکننده باید بر اساس ارزیابی ریسک میکروبی (Microbial Risk Assessment) و ماهیت محصول نهایی، مقادیر پذیرش اختصاصی خود را در مستندات Specification و COA تعریف کند.
کنترل میکروبی پیشگیرانه (Preventive Microbial Control)
کنترل میکروبی مؤثر در مواد اولیه صرفاً به انجام آزمونهای آزمایشگاهی محدود نمیشود؛ بلکه بخش عمدهای از آن باید بهصورت پیشگیرانه و نظاممند در کل زنجیره تأمین و نگهداری مواد اجرا گردد. هدف از کنترل میکروبی پیشگیرانه، جلوگیری از ورود، رشد و تکثیر میکروارگانیسمها در مراحل مختلف دریافت، ذخیرهسازی، انتقال و مصرف مواد اولیه است. این رویکرد در واقع نخستین خط دفاعی سیستم کیفیت محسوب میشود و اجرای دقیق آن از بروز مشکلات بعدی مانند آلودگی متقاطع، افزایش بار میکروبی و ریجکت دستههای تولیدی جلوگیری میکند.
اصول کلیدی کنترل میکروبی پیشگیرانه عبارتاند از:
۱. تأیید و ارزیابی تأمینکنندهها (Supplier Qualification)
پیش از خرید یا دریافت هر ماده اولیه، تأمینکننده باید از نظر انطباق با الزامات GMP، GDP و ISO 9001 مورد ارزیابی قرار گیرد. مستنداتی نظیر گواهی آنالیز (COA)، گواهی استریل یا میکروبی، و سوابق ممیزیهای قبلی باید بررسی و تأیید شوند.
در مورد مواد زیستی یا طبیعی، درخواست اطلاعات مربوط به روش برداشت، فرآوری، و نگهداری ماده از تأمینکننده اهمیت ویژهای دارد، زیرا این مراحل اغلب منبع اصلی آلودگی میکروبی هستند.
۲. شرایط دریافت (Receiving Conditions)
در هنگام دریافت مواد اولیه، باید بررسی شود که بستهبندیها سالم، بدون نشتی، پارگی یا رطوبت باشند. مواد دارای بوی غیرعادی، تغییر رنگ یا نشانههای رشد قارچ باید فوراً قرنطینه شوند تا قبل از انجام آزمون میکروبی وارد انبار نشوند. نمونهبرداری نیز باید در شرایط کنترلشده و با ابزار استریل انجام گیرد تا آلودگی ثانویه ایجاد نشود.
۳. شرایط نگهداری و انبارداری (Storage & Environmental Control)
- دمـا و رطوبت: باید در محدوده تعریفشده برای هر ماده حفظ شوند، زیرا افزایش رطوبت محیط انبار رشد قارچها و باکتریهای هوازی را تسهیل میکند.
- تهویه و گردش هوا: فیلترهای HEPA یا سیستم تهویه با کنترل ذرات معلق میتواند از انتشار اسپورهای قارچی جلوگیری کند.
- چیدمان انبار: مواد باید حداقل ۳۰ سانتیمتر از دیوار و زمین فاصله داشته باشند تا جریان هوا و امکان بازرسی فراهم باشد.
- کنترل آفات و حشرات: برنامه Pest Control منظم و مستندسازیشده باید اجرا شود تا از حضور ناقلان میکروبی جلوگیری شود.
۴. پایش میکروبی محیط (Environmental Monitoring)
برای اطمینان از وضعیت بهداشتی محیطهای انبار و دریافت مواد، پایش دورهای هوا، سطوح و نقاط تماس با مواد اولیه انجام میشود. این پایش میتواند شامل آزمونهای شمارش کل میکروبی (TAMC/TYMC)، نمونهبرداری سطحی (Swab Test) یا پلیتاِکسپوزر در نقاط بحرانی باشد. دادههای حاصل باید تحلیل شوند تا در صورت افزایش بار میکروبی، اقدامات اصلاحی انجام گیرد.
۵. آموزش پرسنل و رعایت بهداشت فردی (Personnel Hygiene)
کارکنانی که با مواد اولیه سروکار دارند باید آموزشهای اختصاصی در زمینه اصول بهداشت فردی، استفاده از لباس کار تمیز، پوشش مو و ماسک، و شستن دستها قبل از ورود به مناطق کنترلشده دریافت کنند. ورود افراد متفرقه یا بیمار به انبار مواد اولیه باید ممنوع باشد.
۶. مدیریت مستندات و رهگیری (Documentation & Traceability)
تمام مراحل دریافت، قرنطینه، نمونهبرداری، نگهداری، و مصرف مواد اولیه باید بهصورت کامل مستندسازی شود. ثبت تاریخچه دما و رطوبت، گزارش پایش محیط، و سوابق آموزشی کارکنان بخشی از الزامات ممیزیهای GMP است و در صورت بروز آلودگی، امکان رهگیری منبع را فراهم میکند.
جمعبندی
کنترل میکروبی مواد اولیه، پایهایترین مرحله از تضمین کیفیت در صنایع دارویی و آرایشی محسوب میشود. اجرای دقیق این آزمونها مطابق فارماکوپههای معتبر، به همراه مدیریت بهداشتی و مستندسازی کامل، تضمینکننده سلامت و کیفیت محصول نهایی است. بیتوجهی به این مرحله میتواند منجر به عواقب جدی از جمله آلودگی متقاطع، توقف تولید، یا ریکال محصول شود.