در گذشته، مطالعات بالینی بهصورت ساختاری کاملاً ثابت و از پیش تعیینشده طراحی میشدند. محققان ناچار بودند در آغاز مطالعه، همه عناصر اصلی مانند حجم نمونه، رژیم دارویی، معیارهای ورود و خروج و اهداف مطالعه را با دقت تعیین و ثبت کنند. در طول اجرای مطالعه، هیچگونه تغییری در این ساختار مجاز نبود؛ چرا که هرگونه اصلاح نیازمند بازنویسی پروتکل و اخذ مجدد تأییدیههای نظارتی بود. این روش که تحت عنوان طراحی سنتی (Fixed Trial Design) شناخته میشود، اگرچه از لحاظ ساختاری قابل پیشبینی و کنترلپذیر بود، اما در بسیاری موارد موجب اتلاف منابع، زمان طولانی، و ناتوانی در واکنش به دادههای واقعی و غیرمنتظره میشد.
با پیشرفت فناوری، رشد ظرفیتهای آماری و نیاز فزاینده به افزایش بهرهوری در توسعه دارو، مدل سنتی مطالعات بالینی به تدریج جای خود را به طراحیهای تطبیقی (Adaptive Designs) داده است. این نوع طراحی، که بر پایه تحلیل دادههای میاندورهای استوار است، امکان ایجاد تغییرات ساختاری در طول اجرای مطالعه را به روشی علمی، شفاف و قابلمدیریت فراهم میسازد.
اهمیت این تحول به حدی است که سازمان غذا و داروی آمریکا (FDA) در سال ۲۰۱۹ با انتشار دستورالعمل رسمی خود با عنوان “Adaptive Designs for Clinical Trials of Drugs and Biologics”، اصول و شرایط استفاده از طراحی تطبیقی را به رسمیت شناخته و آن را ابزاری مؤثر برای بهینهسازی مطالعات و تسریع فرآیند تأیید دارو معرفی کرده است.
در این مطلب، به بررسی دقیقتر طراحی تطبیقی، تفاوتهای آن با مدل سنتی، مزایا، چالشها و انواع مختلف این رویکرد خواهیم پرداخت؛ نگاهی که میتواند چشماندازی نو برای پژوهشگران، شرکتهای دارویی و متخصصان طراحی مطالعات فراهم سازد.
طراحی تطبیقی چیست؟
طراحی تطبیقی روشی در طراحی مطالعات بالینی است که در آن محققان میتوانند در حین اجرای مطالعه و با تکیه بر دادههای حاصل از تحلیلهای میاندورهای، تصمیماتی کلیدی در رابطه با ساختار مطالعه اتخاذ کنند. این تصمیمات ممکن است شامل تغییر در دوز دارو، افزایش یا کاهش تعداد شرکتکنندگان، حذف بازوهای درمانی کماثر، یا حتی ادغام فازهای مختلف مطالعه باشند.
تفاوت بنیادین این طراحی با مدل سنتی در انعطافپذیری ساختاری آن است؛ در حالی که طراحی سنتی ساختاری ساکن دارد، طراحی تطبیقی به مطالعه اجازه میدهد تا در پاسخ به دادههای واقعی در حال اجرا، خود را تطبیق دهد و بهینه شود — بدون نیاز به توقف یا بازنویسی پروتکل.
چگونگی اجرای مطالعه تطبیقی
اجرای طراحی تطبیقی (Adaptive Design) در مطالعات بالینی نیازمند برنامهریزی دقیق، چارچوبهای آماری مشخص، و هماهنگی کامل بین تیمهای تحقیقاتی، آماری، و رگولاتوری است. در ادامه، مراحل و اجزای کلیدی اجرای یک طراحی تطبیقی را بهصورت جزئی و تخصصی توضیح میدهم:
مراحل کلیدی اجرای Adaptive Design
1. تعریف اهداف و استراتژیهای تطبیق
پیش از شروع مطالعه، محققان باید دقیقاً مشخص کنند:
- چه پارامترهایی قرار است تطبیق داده شوند؟ (مثلاً دوز، اندازه نمونه، بازوهای مطالعه)
- چه نوع دادههایی معیار تصمیمگیری خواهند بود؟
- در چه زمانهایی از مطالعه دادهها بررسی خواهند شد؟
این موارد در قالب قوانین تطبیق (Adaptation Rules) تدوین میشوند و باید بهصورت پیشثبتشده (pre-specified) در پروتکل مطالعه و برنامه آماری وارد شوند.
2. طراحی چارچوب آماری و انتخاب مدل مناسب
مدلهای آماری در طراحی تطبیقی پیچیدهتر از مطالعات سنتی هستند و باید توانایی انجام تحلیلهای میاندورهای (interim analyses) را داشته باشند. مهمترین ملاحظات آماری شامل:
- کنترل Type I Error: جلوگیری از نتیجهگیری اشتباه مثبت در اثر تطبیقهای مکرر.
- توان آماری (Power): حفظ توان تشخیص تفاوت واقعی علیرغم تغییرات ساختاری.
- استفاده از روشهای Bayesian یا Frequentist بسته به نوع مطالعه و میزان عدم قطعیتها.
3. برنامهریزی برای تحلیلهای میاندورهای
تحلیلهای میاندورهای ستون فقرات Adaptive Design هستند. در این مرحله:
- دادههای تا آن نقطه جمعآوریشده بررسی میشوند.
- معمولاً یک Data Monitoring Committee (DMC) یا Independent Data Monitoring Committee (IDMC) مسئول انجام این تحلیلهاست.
- براساس خروجیها، تصمیماتی مانند ادامه مطالعه، اصلاح یا توقف گرفته میشود.
مثال: اگر بازوی A در فاز اولیه عملکرد ضعیفی داشته باشد، در تحلیل میاندورهای پیشنهاد حذف آن داده میشود.
4. اجرای عملی تطبیقها
وقتی تصمیم به تغییر ساختار مطالعه گرفته میشود (مثلاً افزایش حجم نمونه)، باید:
- نرمافزارها و پایگاههای داده بروزرسانی شوند.
- پرسنل آموزش ببینند.
- تغییرات به صورت مستند و قابل ردیابی ثبت شوند.
- در صورت لزوم، این تغییرات به مراجع رگولاتوری گزارش شوند (مثلاً به FDA از طریق amendment).
5. یکپارچگی داده و امنیت آماری
- در اجرای Adaptive Design باید Blinding حفظ شود (یعنی تیم اجرایی از نتایج تحلیلی بیخبر بماند).
- تحلیلها باید توسط یک گروه مستقل آماری انجام شوند تا از Bias جلوگیری شود.
- تمام تطبیقها باید در چارچوب استانداردهایی مانند ICH E9 و FDA Guidance انجام شوند.
6. مستندسازی و تعامل با نهادهای رگولاتوری
- باید تمام تصمیمات، تغییرات و دلایل آنها مستند و آماده ارائه به سازمانهای قانونگذار باشند.
- FDA و EMA به تطبیقهایی اجازه اجرا میدهند که از پیش تعریف شده باشند و اجرای آنها باعث خدشه به اعتبار مطالعه نشود.
- وجود ارتباط فعال با regulatory affairs از آغاز مطالعه ضروری است.
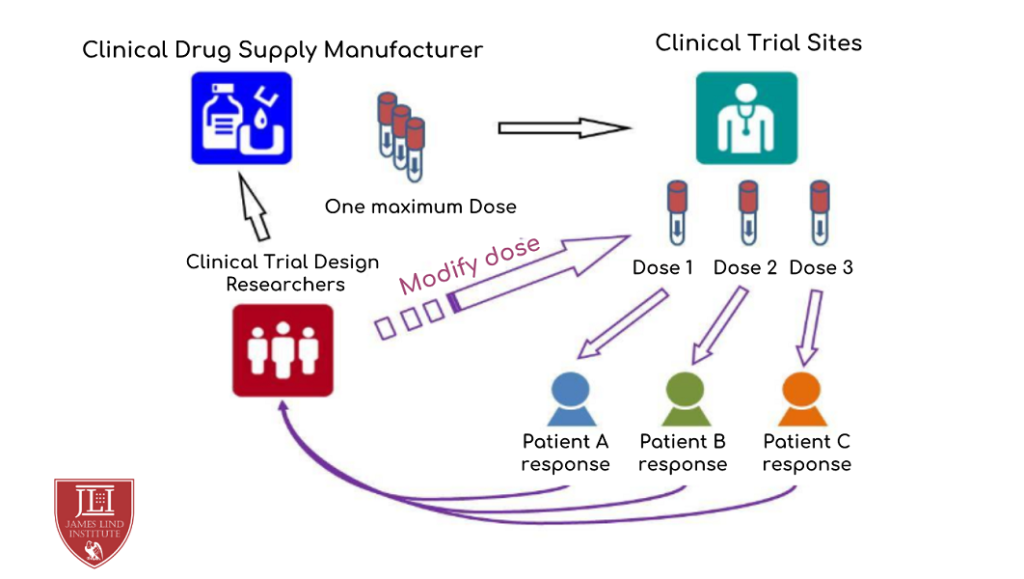
فرض کنید در یک مطالعه فاز ۲ برای بررسی اثربخشی سه دوز از یک داروی جدید:
- در پروتکل ذکر شده که در پایان جذب 100 بیمار، یک تحلیل میاندورهای انجام خواهد شد.
- اگر یکی از دوزها اثربخشی نداشته باشد، آن بازو حذف میشود.
- اگر دو دوز نزدیک به هم اثربخش باشند، مطالعه ادامه مییابد و حجم نمونه بر اساس محاسبات آماری به 300 افزایش پیدا میکند.
- همه این تغییرات توسط کمیته مستقل پایش داده (DMC) تحلیل شده و تیم اجرایی فقط اجرای دستورات را بدون آگاهی از دادهها انجام میدهد.
مزایای طراحی تطبیقی
- کاهش زمان توسعه دارو: با امکان توقف زودهنگام برای موفقیت یا بیاثر بودن، میتوان از صرف زمان غیرضروری جلوگیری کرد.
- افزایش احتمال موفقیت مطالعه: با تمرکز بر بازوهای درمانی مؤثر و حذف گزینههای ضعیف، دقت و اثربخشی افزایش مییابد.
- صرفهجویی در منابع مالی و انسانی: از آنجا که فقط مسیرهای نویدبخش ادامه مییابند، از هدررفت منابع جلوگیری میشود.
- پاسخگویی بهتر به پیچیدگیهای جمعیت بیماران: طراحی تطبیقی امکان تنظیم مطالعه برای گروههای خاص از بیماران را فراهم میسازد.
- تصمیمگیری مبتنی بر دادههای واقعی و زنده: که خود موجب افزایش اعتبار و کارایی مطالعه میشود.
انواع رایج طراحی تطبیقی
- تطبیق دوز: برای یافتن دوز بهینه در مراحل اولیه مطالعه
- بازنگری در حجم نمونه: برای حفظ قدرت آماری در صورت تفاوت با برآوردهای اولیه
- تصادفیسازی پاسخمحور: اختصاص بیشتر بیماران به بازوهای مؤثرتر
- حذف بازوهای بیاثر: با هدف تمرکز بیشتر بر درمانهای امیدوارکننده
- طراحیهای پیوسته بین فازها (Seamless Designs): برای ترکیب فازهای ۲ و ۳ در یک مسیر مطالعاتی واحد
چالشها و الزامات
اگرچه طراحی تطبیقی مزایای چشمگیری دارد، اما پیادهسازی صحیح آن نیازمند رعایت مجموعهای از الزامات است، از جمله:
- تدوین دقیق و از پیشتعیینشده قواعد تطبیق (Adaptation Rules)
- طراحی آماری پیشرفته و استفاده از مدلهای پیچیده
- بهرهگیری از تیمهای تحلیلی مجرب و نرمافزارهای تخصصی
- رعایت استانداردهای رگولاتوری برای حفظ صحت آماری، از جمله کنترل خطای نوع اول
جمعبندی
طراحی تطبیقی نشاندهنده تحول مهمی در مسیر توسعه دارو است؛ تحولی که با استفاده از علم داده، تحلیل لحظهای و تصمیمگیری پویا، موجب افزایش شانس موفقیت، کاهش هزینه و تسریع فرآیند ورود داروهای نوین به بازار میشود. با پذیرش این رویکرد از سوی نهادهای قانونگذار بینالمللی و گسترش استفاده از آن در مطالعات بالینی، انتظار میرود که در سالهای آینده طراحی تطبیقی بهعنوان یکی از ارکان اصلی در توسعه درمانهای مؤثر، ایمن و هدفمند شناخته شود.